top of page
"Interactuando más allá del Salòn de Clases"
Docente: Lisbeth C. Madera R.
los Gases Ideales
Es aquel en que sus moléculas o átomos no se atraen entre sí.
los gases nobles, se comportan como gases ideales cuando se encuentran en condiciones normales de presión y temperatura (presión de 1 atmósfera y a una temperatura de 273,15 kelvin, o lo que es lo mismo a 0ºC.)
En condiciones normales tales como condiciones normales de presión y temperatura, la mayoría de los gases reales pueden ser tratados como gases ideales. Por lo que su comportamiento se puede explicar de una forma fija, cumpliendo 3 relaciones o leyes: Ley de los gases ideales, la ley de charles, Gay-Lussac y la Ley de Boyle.

ley de Charles: Al mantener presión y masa del gas constante, el volumen se comporta en relación directa a la temperatura.

ley de Boyle: Al mantener la temperatura y masa del gas constante, el volumen se comporta en relación inversa a la presión.
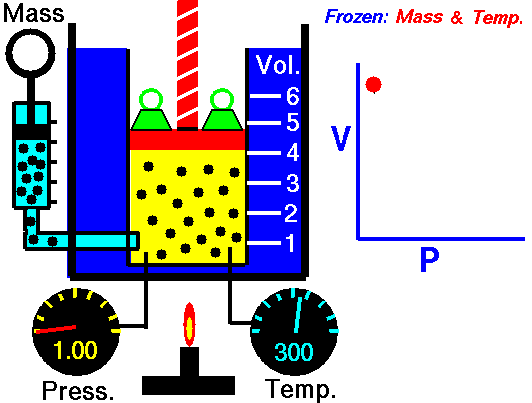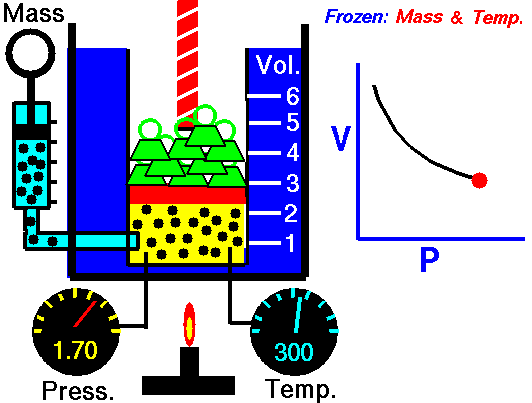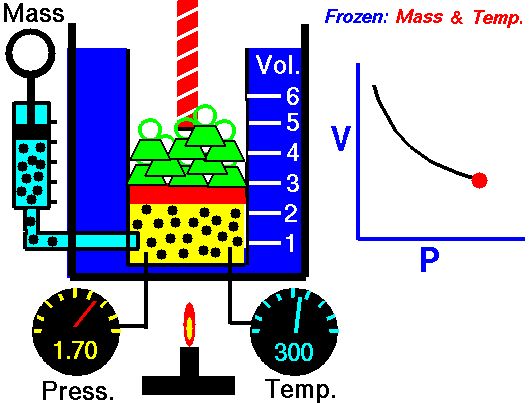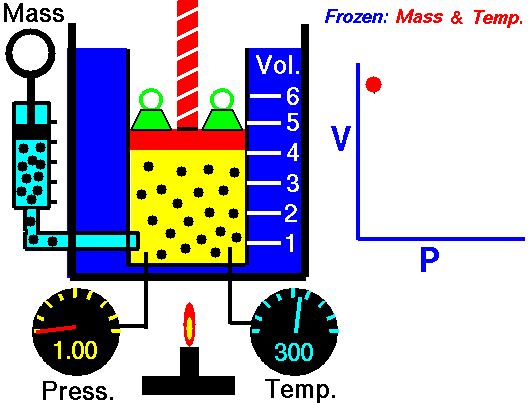
ley de Gay-Lussac: Al mantener el volumen y masa del gas constante, la presión se comporta en relación directa a la temperatura.

ley Combinada de los gases: Cuando hay una variación de la presión, el volumen y la temperatura del gas, aplicamos la ley combinada de los gases ideales, que no es mas que la unión de la ley de Boyle, Charles y Gay-Lussac.
P1 V1 T2 =P2 V2 T1
Ecuación de Estado de los Gases: Describe la relación entre la presión, el volumen, la temperatura y el número de moles.
P V = n R T
Donde:
P=Presión
V=Volumen en (L)
n= Número de moles (n=g/Ma)
R=Constante universal de los gases ideales (R=0,082 atm L/mol K) ó (R=62,36 mmHg L/mol K)
T=Temperatura absoluta o Kelvin
bottom of page

